Már-már klasszikusnak számító genetikai módosító módszerek
Az előző bejegyzésben olyan molekuláris genetikai módszereket mutattunk be, melyek a sejtek és szövetek állapotának megvizsgálására voltak alkalmasak. Ha valamit megvizsgálunk, ismereteket szerzünk róla, összefüggéseket tárunk fel. De, mint azt már sokszor emlegettem, ha szigorúan tudományosak akarunk lenni, akkor meg kell különböztetni az összefüggést az okságtól. Azaz, nem elég azt látnunk, hogy A és B együtt fordul elő, azt is meg kell vizsgáljuk, hogy A okozza B-t, fordítva, közös okuk van, vagy véletlen az összefüggés. Ezt ugye úgy tehetjük meg, hogy egy kísérlet során megváltoztatunk valamit, és ennek következményeit vizsgáljuk, nem csak megfigyelünk. A mai bejegyzésben azt mutatom be hogyan működnek azok a célzott és kifinomult genetikai beavatkozó módszerek, amiket már lassan rutinszerűen használunk.
Cre-Lox és Flp-FRT rekombinációs rendszerek: Ide a rozsdás genetikai bökőt!
A fentiek olyan helyspecifikus rekombinációs technikák, amelyeket arra fejlesztettek ki, hogy a genetikai módosításokat csak meghatározott sejtekben vagy adott időpontban lehessen végrehajtani. Mindkét módszer egy rekombináz enzimre épül: a Cre a LoxP, a Flp pedig az FRT szekvenciákat ismeri fel, és ezek között végez kivágást, beillesztést vagy inverziót, a két szekvencia egymáshoz viszonyított orientációjától függően.
Már másodszor jönnek elő azok az enzimek amik a DNS-t egy meghatározott helyen, szekvenciánál vágják. Először ugye a Southern blottingnál, ahol a méret szerinti szétválasztáshoz a DNS-t először jellegzetes mintázatban fel kellett darabolni. Ezeket az enzimeket restrikciós enzimeknek és rekombináz enzimeknek hívják, és mindkettőnek természetes, biológiai eredete van.
A restrikciós enzimek baktériumokból származnak, és az eredeti feladatuk az, hogy megvédjék a baktériumot a vírusoktól. Ha egy baktériumot megtámad egy vírus, annak DNS-e bekerül a sejtbe, és a restrikciós enzim felismeri benne a „nem saját” DNS-szakaszokat, majd szétvágja a vírus DNS-ét, mielőtt az kárt okozhatna. A restrikciós enzimek általában 4–8 bázispár hosszú, meghatározott DNS-szekvenciát ismernek fel. Nagyon gyakran ezek a szekvenciák palindromok, vagyis mindkét DNS-szálon „ugyanúgy olvashatók”.
Például EcoRI itt vág:
5’ – G | AATTC – 3’ (a vágás helyét a | karakter jelzi)
3’ – CTTAA | G – 5’ (a vágás 'ragadós' véget hoz létre, melyet könnyű összekapcsolni más DNS darabokkal)
Mivel egy 6 bázispár hosszú szekvencia átlagosan kb. 4⁶ ≈ 4000 bázisonként fordul elő, a genom jósolható méretű darabokra esik szét. A kutatók ezt a tulajdonságot használják ki a Southern blotban: a DNS-t pontos helyeken feldarabolják, hogy méret szerint szét lehessen választani.
A Cre enzim ezzel szemben egy rekombináz, amely eredetileg egy baktériumvírusból (bakteriofágból) származik. A természetben a feladata az, hogy a vírus saját DNS-ét átrendezze vagy kivágja a baktérium genetikai állományából, amikor a vírus életciklusa ezt megkívánja. A Cre pontosan felismeri a LoxP nevű DNS-szakaszokat, és csak ezek között hajt végre vágást és újraösszekapcsolást.
A Cre nem sok helyen, hanem nagyon ritkán előforduló -a mi esetünkben mesterségesen beépített szekvenciákat- ismer fel.
LoxP szekvencia – 34 bázispár
ATAACTTCGTATA | GCATACAT | TATACGAAGTTAT
Felépítése: 13 bp – felismerő rész, 8 bp – középső „irányjelző”, 13 bp – felismerő rész. A Cre nem egyszerűen feldarabolja a DNS-t, hanem kivágja a közte lévő szakaszt, vagy megfordítja, vagy áthelyezi, attól függően, hogyan állnak a LoxP helyek. A vágás a középső 8 bázispárnál történik, majd a DNS újra össze is kapcsolódik.
A kutatók ezt a „precíz ollót” használják fel arra, hogy élő szervezetekben szándékosan ki- vagy bekapcsoljanak géneket.
Összefoglalva: ezek az enzimek eredetileg mikrobák túlélését szolgálták, a kutatók pedig megtanulták őket „kölcsönvenni”, hogy a DNS-t ugyanilyen pontosan és megbízhatóan tudják vizsgálni vagy módosítani a laborban.
Ha a rekombinázt egy sejttípus-specifikus promóter irányítja, akkor a genetikai változás kizárólag abban a sejtcsoportban következik be, amely ezt a promótert kifejezi – így lehet célzottan módosítani például csak a gátló idegsejteket vagy csak a dopaminerg sejteket. A technika időben is szabályozható: a Cre-ERT2 és Flp-ERT2 változatok csak akkor lépnek működésbe, ha a kutató tamoxifent ad (lásd alant), így a rekombináció akár egy fejlődési szakaszban vagy egy kísérlet előtt indítható el.
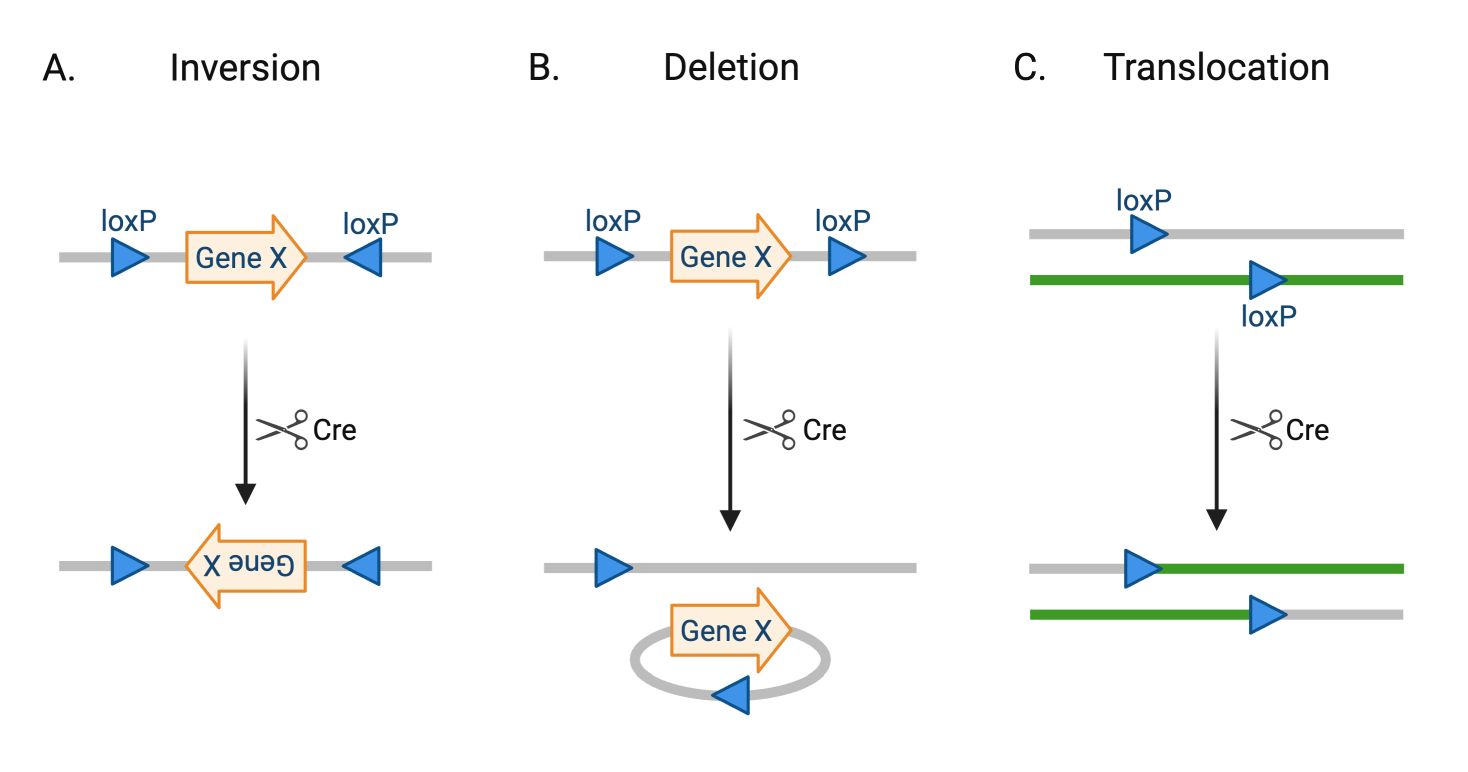
A Cre-Lox klasszikusan a génkiütés (knockout) és génaktiváció (knock-in) eszköze, de bonyolultabb műveletekre is használható, például gének cseréjére vagy a fluoreszcens jelzések (reporterek) aktiválására különböző sejtcsoportokban. A Flp-FRT rendszer ugyanígy működik, de másik enzim–célhely párost alkalmaz, és gyakran használják kettős rekombinációs logikai kapuk kialakítására: például csak azok a sejtek aktiválódnak, amelyek egyszerre expresszálják a Cre-t és a Flp-et, vagy csak azok, amelyek egyik rekombinázt expresszálják, a másikat nem. Ez különösen akkor hasznos, ha egy bonyolult agyterületen belül szeretnénk nagyon finom alcsoportokat megcélozni.
A két rendszer stabil, öröklődő változásokat hoz létre, így transzgénikus egértörzsek százai épülnek rájuk, a modern idegtudomány egyik legfontosabb genetikai alapját képezve. Segítségükkel pontosan meghatározható, mely sejtek milyen szerepet játszanak egy viselkedésben, egy tanulási folyamatban vagy egy neurológiai betegség kialakulásában.
DREADD technika: A piros vagy a kék tablettát választod?
A DREADD technika olyan módszer, amellyel a kutatók tartósan befolyásolni tudják idegsejtek működését. A DREADD-ek (Designer Receptors Exclusively Activated by Designer Drugs) olyan genetikailag módosított receptorok, amelyeket a sejtek normál körülmények között nem használnak, és amelyeket a természetben elő nem forduló, hatóanyagok aktiválnak. Ez azt jelenti, hogy a kutató pontosan oda juttatja be a receptort – például vírusvektorral – ahol sejteket szeretne befolyásolni. Ezután egy tabletta, injekció vagy oldat formájában adható vegyülettel „kapcsolja be” vagy „kapcsolja ki” ezeket a sejteket. A DREADD-ek két fő típusa létezik: az egyik a másodlagos hírvivő rendszereket használva serkenti, a másik gátolja a célzott neuronokat. Ha serkentő DREADD-et fejeztetnek ki, az adott agyterület neuronjai aktívabbá válnak a hatóanyag beadásakor, így meg lehet vizsgálni, milyen viselkedést vagy élettani folyamatot indítanak el. Ha gátló DREADD-et használnak, akkor a sejtek „elcsendesednek”, és kiderül, milyen funkció esik ki vagy módosul ennek hatására. Ez különösen hasznos a bonyolult agyi hálózatok megértésében, mert megmutatja, mely sejtcsoportok felelnek egy adott viselkedési mintáért, emlékért vagy érzékelési folyamatért.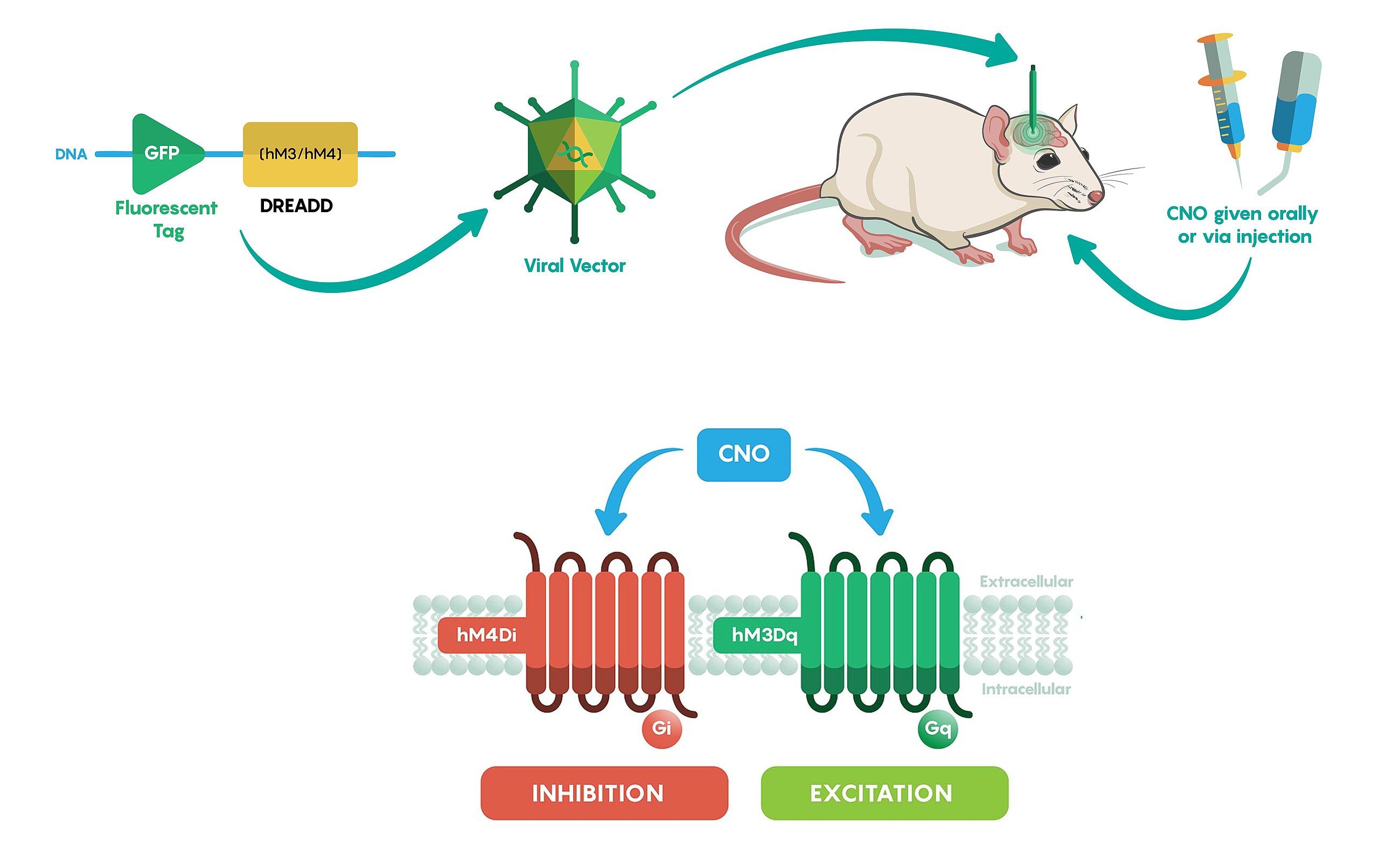
A módszer előnye, hogy nagyon célzott és kíméletes: az agyba csak egyszer kell bevinni a receptort, és ezt követően a sejtek működése akár hetekig vagy hónapokig szabályozható egy egyszerűen adható anyaggal. A DREADD aktiváló molekulák önmagukban hatástalanok az agy többi részére, így a manipuláció szinte mellékhatások nélküli. Emiatt a technikát széles körben használják olyan kérdések vizsgálatában, mint például hogy mely idegsejtek szabályozzák a szorongást, hogyan működnek a memóriahálózatok, vagy milyen sejtek tartják fenn a napi ritmust. A DREADD tehát egy olyan finom „távirányító” az idegsejtek felett, amellyel a kutatók biztonságosan, visszafordíthatóan és nagyon pontosan tudják manipulálni az agy működését.
Tet-On/Tet-Off rendszerek: Ezt vedd be, ettől máshogy leszel!
A Tet-On/Tet-Off rendszerek olyan kapcsolható génexpressziós technikák, amelyek lehetővé teszik, hogy egy tetszőleges gént időben szabályozhatóan kapcsoljunk be vagy ki sejtekben vagy élő állatokban. A módszer alapja egy módosított bakteriális szabályozófehérje (tTA vagy rtTA) és egy hozzá tartozó mesterséges promoter (tetO/TRE). A Tet-Off rendszerben a tTA fehérje normál esetben aktiválja a gént, de ha a kutató tetraciklint vagy doxiciklint ad, akkor a fehérje elveszíti kötőképességét, és a gén kikapcsol. A Tet-On rendszer ennek fordítottja: a gén csak akkor kapcsol be, ha jelen van a doxiciklin, mert a módosított rtTA fehérje csak ekkor képes a promoterhez kötni.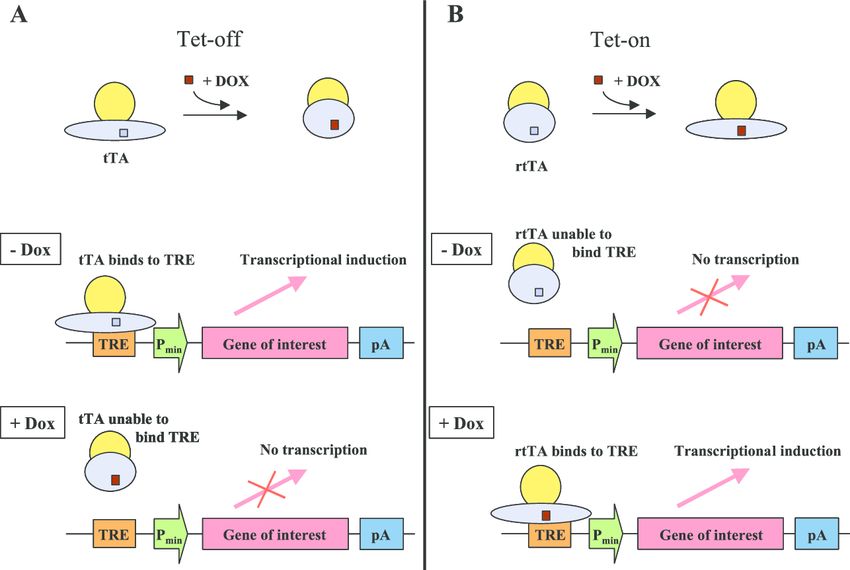
A rendszer nagy előnye, hogy a gének expressziója tetszőleges időpontban vezérelhető, ami kritikus például fejlődési folyamatok, agyi átrendeződések vagy viselkedési kísérletek vizsgálatánál. Megnézhetjük például, hogy egy adott géntermék mikor és milyen szerepet játszik az embrionális fejlődésben. Emellett dózisfüggő: minél több doxiciklin kerül a szervezetbe, annál erősebb a gén aktivációja, így finoman hangolható a kifejeződés mértéke. A technika jól kombinálható sejttípus-specifikus promóterekkel és vírusvektorokkal, így a vizsgálat céljától függően akár csak egyetlen sejttípusban, például gátló interneuronokban vagy dopaminerg sejtekben kapcsolható be egy transzgén.
Transzgénikus Tet-On/Tet-Off egérvonalak széles skálája létezik, melyekkel például riportergének, opszinok vagy patológiás fehérjék időzített expressziója tanulmányozható. A módszer különösen nagy értéke, hogy reverzibilis: ha a kutató abbahagyja a doxiciklin adagolását, a gén kifejeződése leáll, így ugyanazon állaton belül vizsgálható egy gén funkciójának megjelenése és eltűnése. Összességében a Tet-On/Tet-Off rendszerek a modern idegtudomány egyik legfontosabb genetikai „kapcsolótábláját” jelentik, amelyekkel pontosan és megbízhatóan szabályozható a gének működése.
A következő passzusokban az újkeletű technikákat bemutató korábbi ámokfutást lassú szemlélődő sétával heverjük ki.
Szerző: Gulyás Attila





