A sejt és hálózati aktivitás mérésére alkalmas optikai érzékelő rendszerek
A fiziológiai módszerek lajstromozása környékén bemutattam a transzgenikus technológiával sejtekben kifejezhető Ca érzékelő molekulákat (szenzorok, GCaMP család), melyek lehetővé teszik nagy sejtpopulációk aktivitásának, illetve egyedi sejtek jelintegrációs folyamatainak mérését. Azonban számos más optikai szenzor-molekula család létezik. Ezeket mutatjuk be ebben a bejegyzésben. Az optikai szenzorok erőssége, hogy képalkotó eljárásokkal, fénysugarakat rögzítő kamerákkal gyorsan, 2 vagy 3D képet lehet nyerni egy nagy terület, pl. egy agykérgi terület vagy kisebb állatok esetében az egész agy aktivitásáról.
Az elektromos jelek méréséhez képest ezek a szenzorok sokkal több „csatornát” (pixelt) engednek meg, az elektromos zajokra nem érzékenyek, és ha kívánjuk kiválasztott sejtcsoportokban fejezhetők ki.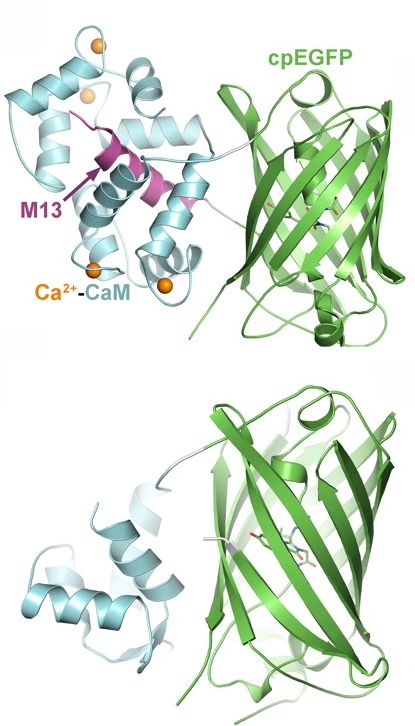 Amikor egy indikátor molekula az általa érzékelt anyagot megköti, megváltoztatja elektronszerkezetét vagy konformációját, 3D szerkezetét (elcsavarodik). Ezek következtében fényelnyelési és fénykibocsájtási spektruma megváltozik, azaz más színben vagy mennyiségben bocsájt ki fényt gerjesztés hatására, máshogy fluoreszkál. A szenzorok lehetnek: a) kémiailag szintetizált molekulák, b) fluoreszcens fehérjék, vagy ezek kimérái más fehérjékkel, c) olyan fehérjék, amelyek kémiai szintetikus molekulákat kötnek. A b esetben gyakran egy kiméra (két eltérő fehérjéből összeszerkesztett) fehérjét készítenek, melynek egyik része felelős az érzékelendő anyag kötéséért, a másik pedig a fény kibocsájtásért. A fehérjéket úgy szerkesztik egymáshoz, hogy amikor a kötő rész anyagot köt, térszerkezete megváltozik (megcsavarodik) és megtekeri a fényt kibocsájtó molekulát, mely ennek hatására megváltoztatja fluoreszcens tulajdonságait. Ez a moduláris megközelítés lehetővé teszi különböző szenzorok és eltérő színű fluoreszkáló fehérjék kapcsolását. Az ingerületátvivőanyag és metabolikus érzékelők esetében olyan megoldás is létezik, hogy egy enzim hatású fehérje reagál a vizsgált anyaggal és a reakciótermék bocsájt ki fényjelet.
Amikor egy indikátor molekula az általa érzékelt anyagot megköti, megváltoztatja elektronszerkezetét vagy konformációját, 3D szerkezetét (elcsavarodik). Ezek következtében fényelnyelési és fénykibocsájtási spektruma megváltozik, azaz más színben vagy mennyiségben bocsájt ki fényt gerjesztés hatására, máshogy fluoreszkál. A szenzorok lehetnek: a) kémiailag szintetizált molekulák, b) fluoreszcens fehérjék, vagy ezek kimérái más fehérjékkel, c) olyan fehérjék, amelyek kémiai szintetikus molekulákat kötnek. A b esetben gyakran egy kiméra (két eltérő fehérjéből összeszerkesztett) fehérjét készítenek, melynek egyik része felelős az érzékelendő anyag kötéséért, a másik pedig a fény kibocsájtásért. A fehérjéket úgy szerkesztik egymáshoz, hogy amikor a kötő rész anyagot köt, térszerkezete megváltozik (megcsavarodik) és megtekeri a fényt kibocsájtó molekulát, mely ennek hatására megváltoztatja fluoreszcens tulajdonságait. Ez a moduláris megközelítés lehetővé teszi különböző szenzorok és eltérő színű fluoreszkáló fehérjék kapcsolását. Az ingerületátvivőanyag és metabolikus érzékelők esetében olyan megoldás is létezik, hogy egy enzim hatású fehérje reagál a vizsgált anyaggal és a reakciótermék bocsájt ki fényjelet.
Nézzük milyen optikai szenzorokat ismerünk. Kezdjük a legismertebbel.
A. Kalcium-érzékelő szenzorok (Ca-imaging)
Mit mérnek?
Az idegsejtekbe depolarizációját (aktiválódás) követő Ca²⁺-ion beáramlást érzékelik. Ez egy késleltetett, de nagy amplitúdójú jel. Két fő típusuk van: kémiai Ca-festékek (pl. Fura-2, Fluo-4) és genetikailag kódolt Ca-indikátorok (pl. GCaMP6, jGCaMP7, GCaMP8). Fő előnyeik:
-Nagy jelváltozás (ΔF/F=az intenzitás változása/összes intenzitás, gyakran 100% fölött), ezért jó jel/zaj viszonyt adnak.
-Könnyen alkalmazhatók in vivo is, célzottan expresszálhatók adott sejttípusokban.
Korlátaik:
-Lassú kinetika (több 10–100 ms-be és kikapcsolás), mivel a Ca²⁺-ionoknak be kell jutnia a sejtbe és hozzákötődnie a festékhez. Ezért az akciós potenciál időzítését pontatlanul követik, illetve a sejt Ca²⁺ szintje és az akciós potenciál közöttibonyolult összefüggés miatt nem is teljesen egyértelmű milyen viszonyban áll az akciós potenciállal, azaz mennyire jól jelzi a sejt kisülését.
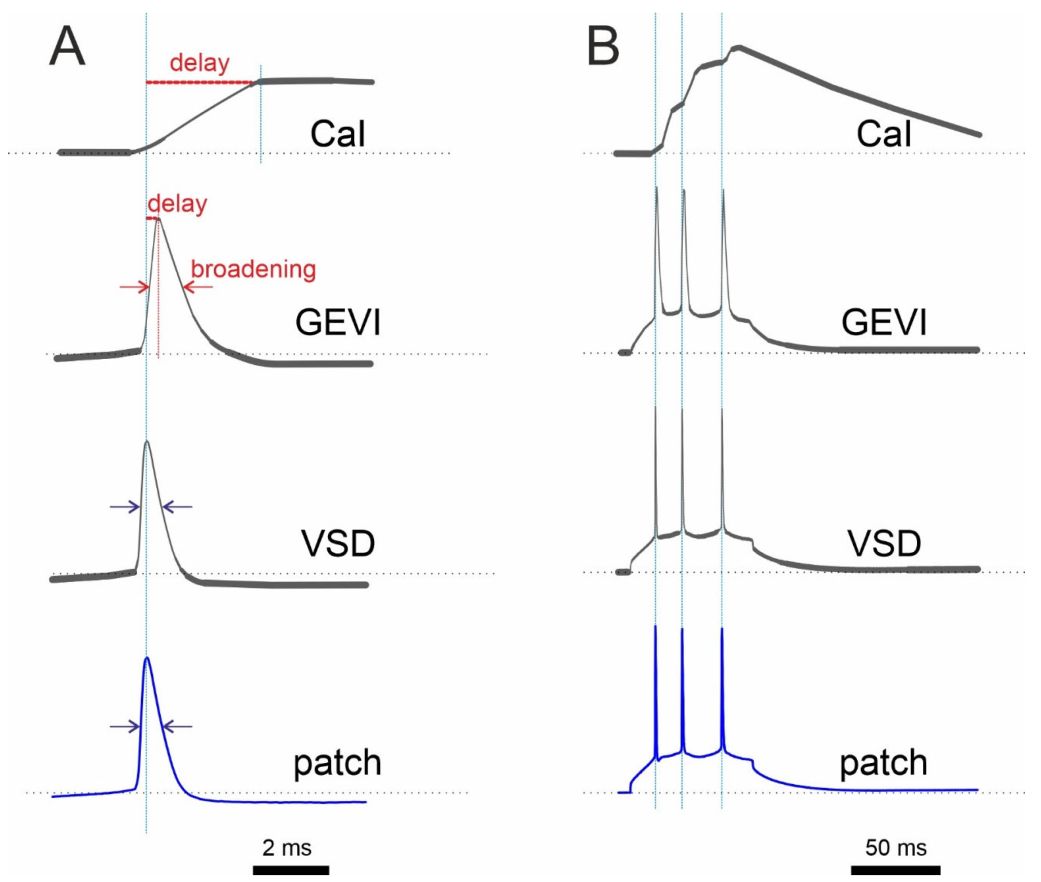
B. Feszültség-érzékeny optikai szenzorok (Voltage Imaging)
Közvetlenül a membránfeszültséget mérik, elméletben milliszekundumos pontossággal. A Ca szenzorokhoz hasonlóan két fő kategóriájuk van: 1) feszültség-érzékeny festékek (VSD-k, pl. ANEPPS, RH-1691, Di-4-ANEPPS), melyek membránba épülő kis molekulák, amelyek fluoreszcenciája változik a transzmembrán elektromos térrel. 2) genetikailag kódolt feszültségindikátorok (GEVI-k, pl. ASAP1–5, Ace2N, ArcLight, QuasAr, SomArchon, Voltron). Ezek fehérjék, amelyeket adott sejtekben expresszálunk, és a membránfeszültség módosítja a fénykibocsájtásukat.
Időbeli felbontásuk elérheti vagy meghaladhatja a patch-clamp elektródákkal mért elektromos jelek sebességét. Sajnos azonban egészen mostanáig sok gyakorlati probléma adódott velük, ezért maradt el 10 évvel a használatuk a Ca indikátoroktól. Nagyon kicsi jelváltozást mutattak (ΔF/F gyakran 1–5%), emiatt nehéz volt jelüket a zajból kibogarászni. Ráadásul gyors reakciójukat nem tudták követni a korábbi képalkotó sebesség rendszerek. Az elmút 5 évben nagy fejlődés történt ezen a területen, erről a következő bejegyzésben számolunk be.
C. Neurotranszmitter-érzékelő indikátorok
Nem elektromos aktivitást, hanem kémiai hírvivők felszabadulását mérik, jelzik, gyorsak.
Típusaik:
Glutamát-érzékelők: iGluSnFR, SF-iGluSnFR, iGluu
GABA-érzékelők: iGABASnFR
Dopamin-érzékelők: dLight1, GRAB-DA
Acetilkolin-érzékelő: GACh
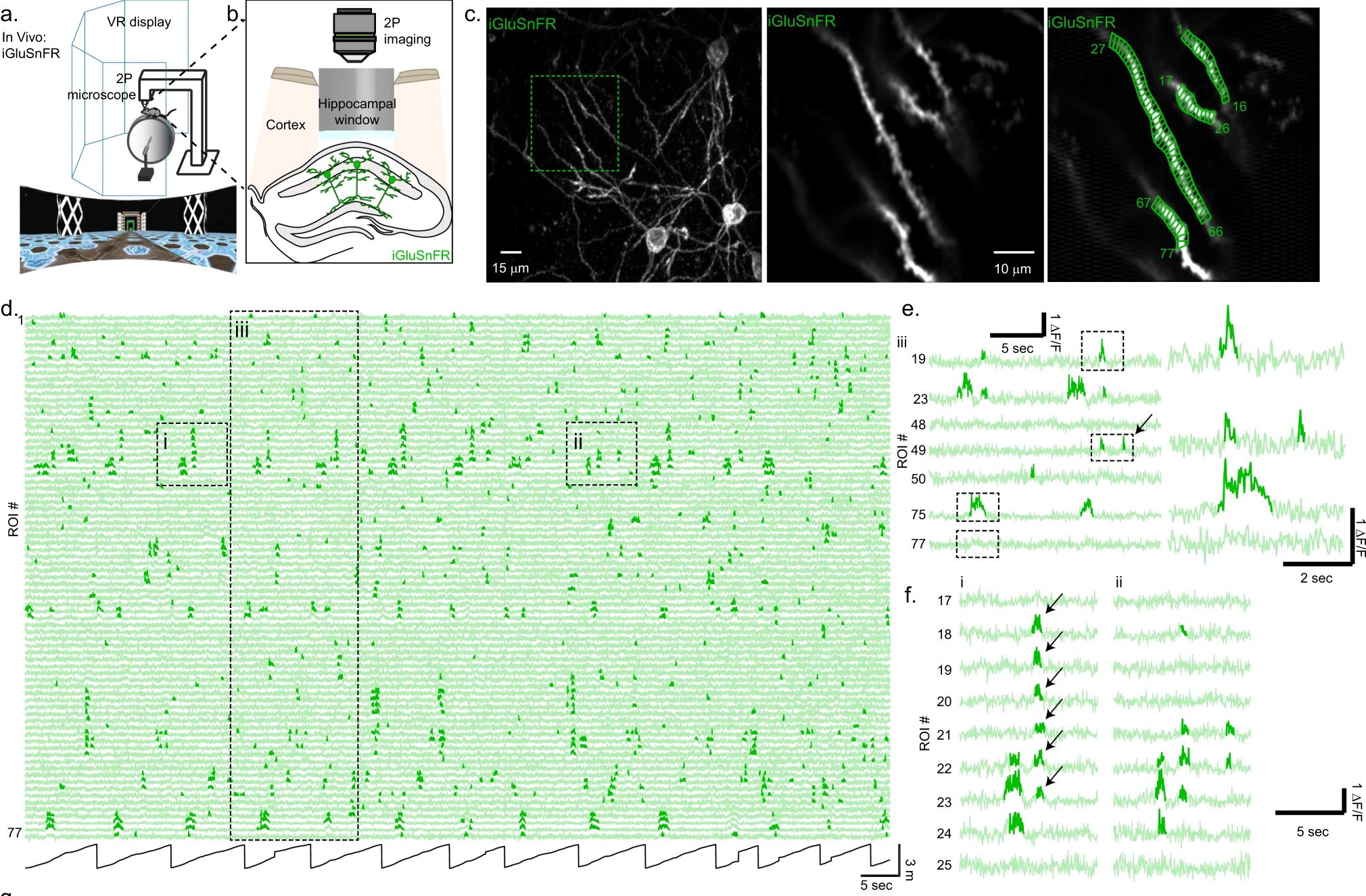
Szemléletes térképet adnak mind a jelfeldolgozásban fontos gyors transzmitterek (Glutamát, GABA), mind a modulációban fontos, kicsit lasabban ható (Dopamin, ACh) transzmitterek szinaptikus aktivitásáról. Nem közvetlenül a neuron tüzelését mérik, hanem a felszabadult ingerület átvivő anyag jelenlétét. De ez nem feltétlenül hiba, hiszen a hatást a felszabadult transzmitter váltja ki és erre vagyunk kíváncsiak.
D. Metabolikus és pH-érzékelő szenzorok
Az idegsejtek anyagcsere folyamatiról (energiaszint) adnak képet (pHluorin, Peredox-NADH/NAD+ arány) a genetikai metabolikus bioszenzorok
Az idegsejteknek a hálózati aktivitás függvényében hirtelen nagyon sok energiára lehet szükségük az akciós potenciálok és a membránpotenciál fenntartásához. Elsődleges tápanyagok a glükóz lebontása két lépésből áll a glikolízisből, a cukor elemekre bontásából és a sejtlégzésből, ahol is az elemeket a mitokondriumok elégetik és a keletkező NADH-n keresztül ATP-ben tárolja az energiát, amivel aztán fizetnek a drága membrán potenciál fenntartó folyamatokért. A glikolízis egy lassú folyamat, azaz meghatározza azt, hogy az idegsejt mennyi energiát tud időegység alatt termelni. Szerencsére sürgős esetekben az asztrociták (gliasejtek) segítenek a neuronoknak. Ők sok glükózt képesek felvenni és az türelmesen elkezdik lebontani glikolízissel, többek között tejsavvá (laktát). Amikor az idegsejtek aktívvá válnak, glutamátot (a serkentő átvivő-anyagot) és K+ ionokat bocsájtanak a sejtközötti térbe. Mindkét anyagot érzékelik a gliasejtek és elkezdenek az idegsejteknek tejsavat átadni, amit ők mitokondriumaik segítségével gyorsan tudnak égetni és feltölteni ATP készletükt. De a gliák az idegsejtek NADH és ATP szintjét is figyelik, hogy mikor kell segíteni.
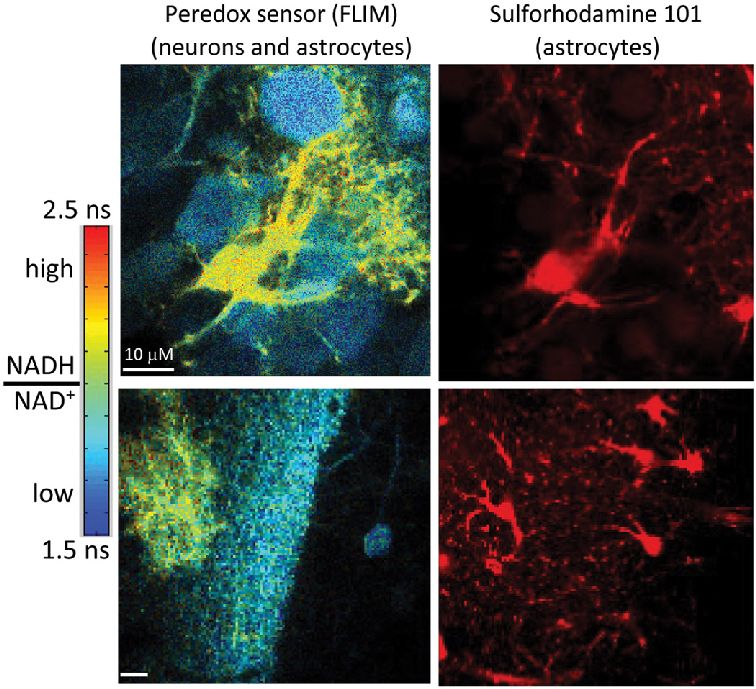
A metabolikus optikai szenzorok tehát azt teszik lehetővé, hogy valós időben lássuk egy idegsejt energia- és redoxállapotát. A NADH/NADPH-érzékelők megmutatják, mennyire aktív a mitokondrium, a sejtek elsődleges erőműve. Tud-e elegendő energiát adni a sejtlégzés vagy megnőtt-e az oxidatív terhelés. Az ATP- és laktát (tejsav)-szenzorok feltárják, hogyan oszlik meg az energia a neuronok és a glia között: mikor fogy el az ATP egy szinapszisban, és mikor segít be az asztrocita laktáttal.
Ezek a szenzorok összességében nem egy-egy molekulát mérnek, hanem a sejtműködés mögött álló energetikai és kémiai folyamatokat: azt, hogy a neuron és a glia hogyan osztják be az energiát, mikor alakul ki energiahiány, és hogyan támogatják egymás működését.
A pH-érzékeny mutatók jelzik a szinaptikus és egyéb szállító vezikulák állapotát és a sejt metabolikus váltásait, így közvetlenül követhető az exocitózis és a sejt kémiai környezetének változása. A dolog hátterében az áll, hogy egy szinaptikus vezikula belseje savas, meg van töltve H+ ionokkal, ugyanis ezek kiáramlása hajtja azokat a pumpákat, amik a transzmittereket csomagolják a vezikulákba. Amikor egy vezikula kiürül, a H+ ionok kiáramlanak, azaz tartalma lúgosabbá váli, a pH nő. Amikor endocitózissal újra alakul, pH-ja ismét esik. Azaz, a pH mérésével a vezikulák aktivitása és ciklusa mérhető.
Azzal folytatjuk, hogy milyen fejlődés történt a közelmúltban, az idegrendszer kutatásában használt optikai érzékelők Szent-Grálja, a feszültségérzékeny szenzorok terén.
Szerző: Gulyás Attila





